기초과학연구원 김진수 연구팀 유전자 가위 첫 동물실험 성공
생명체에 대한 모든 정보를 담고 있는 DNA는 네 개의 염기로 구성돼 있다. 아데닌(A), 티민(T), 시토신(C), 구아닌(G) 염기는 서로 쌍을 이뤄 순서를 만들고 3개의 염기를 조합해 코돈(Codon)으로 유전 정보를 저장한다. DNA 염기서열이 중요한 이유는 단일 염기 하나만 잘못돼도 심각한 병을 초래하기 때문이다. 낭성 섬유증, 겸상 적혈구 빈혈증 등은 특정 염기 하나가 잘못돼 발생하는 대표적인 유전질환이다.
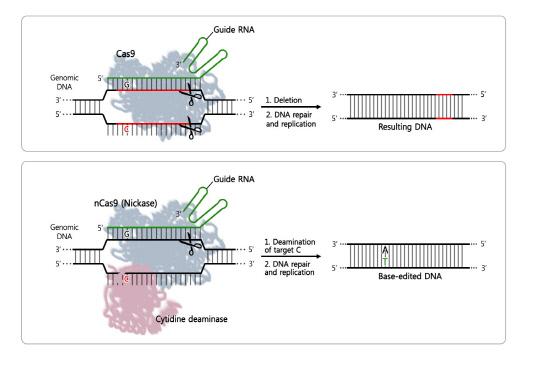
현재 널리 활용되는 크리스퍼 유전자가위(CRISPR Cas9 혹은 CRISPR Cpf1)는 표적인 DNA 염기서열을 찾아 결합한 뒤 이 부분을 잘라내어 제거하거나, 새로운 염기서열로 교체한다. 이 유전자가위는 두 가닥으로 된 DNA 염기서열을 잘라 유전자를 교정하지만, 특정 염기 한 개를 바꾸는 것은 매우 어려웠다. 한편 지난해 학계에 보고된 염기교정 유전자가위는 염기 하나를 교체할 수 있다는 게 특징이다. 염기교정 유전자가위가 동물 개체수준에서 제대로 작동함을 이번 연구에서 확인한 만큼, 앞으로 난치성 유전질환 연구에 다양하게 활용될 것으로 기대된다.
염기교정 유전자가위는 시토신을 분해하는 탈아미노효소와 DNA를 한 가닥 자르는 Nickase Cas9(nCas9)로 구성된다. 시토신 탈아미노효소가 DNA 서열에서 시토신(C)을 찾아 우라실(U, DNA의 유전정보가 RNA에 전달될 때는 티민을 우라실로 바꾸면, 이후 DNA 복구 과정에 따라 우라실(U)은 티민(T)이 된다. 연구진은 이러한 염기 변환으로 정확하게 원하는 형질 변환을 이루는 데 성공했다.
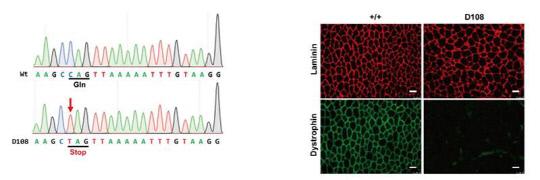
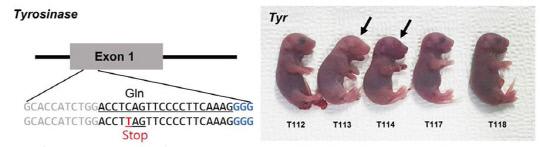
IBS 연구진은 크리스퍼 염기교정 유전자가위를 전기천공법과 미세주입법을 이용해 생쥐 배아에 전달했다. 근육세포의 안정적 유지에 관여하는 Dystropin (Dmd) 유전자와 멜라닌 색소 형성에 관여하는 Tyrosinase (Tyr) 유전자의 염기 교체를 시도했으며 그 결과, 돌연변이 생쥐를 만드는데 성공했다. Dmd 유전자의 염기를 교체해 근육이 퇴행되는 생쥐를 Tyr 유전자의 염기교체로 백색증(Albino) 유도 생쥐를 만들었다. 또 연구진은 전 유전체 시퀀싱으로 표적 위치에만 정확하게 유전자 변이가 발생했음을 확인했다.
이번 연구는 난치성 유전질환 치료제를 위한 형질전환 실험 동물 제작에 큰 도움이 될 것으로 보인다.
이번 연구를 이끈 김진수 단장은 "크리스퍼 염기교정 유전자가위는 일반적인 유전자가위와 달리 DNA 두 가닥을 자르지 않고, 단일 염기를 치환해 정교한 유전자 교정 도구로 활용할 수 있다"며 "이번 연구는 유전질환의 원인이 되는 돌연변이를 배아 수준에서 정밀하게 교정할 수 있는 가능성을 제시한다"고 말했다.
이번 연구결과는 생명공학 분야 권위 있는 학술지 네이처 바이오테크놀로지(Nature Biotechnology, IF 41.514)7)` 에 28일 오전 1시 게재됐다.
김달호 기자
<저작권자ⓒ대전일보사. 무단전재-재배포 금지>